170
жденных крахмальных зерен, а следовательно, больше атакуемость крахмала
β
-амилазой:
Однако нередуцирующих участков, доступных для воздействия присут-
ствующей в муке
β
-амилазы, явно недостаточно, чтобы обеспечить мальтозой
дрожжевые клетки при приготовлении теста. В связи с чем важнейшей характе-
ристикой качества муки, кроме содержания клейковины, является амилолити-
ческая активность муки, которая связана с содержанием в муке
α
-амилазы.
α
-Амилаза – водорастворимый глобулярный белок, металлопротеин, со-
держащий в качестве кофактора ионы кальция. При их отсутствии фермент
инактивируется. Все
α
-амилазы устойчивы к действию протеолитических фер-
ментов.
α
-Амилаза – четко выраженный эндофермент, действующий на внут-
ренние
α
-1,4-О-гликозидные связи в любой части молекулы крахмала без ка-
кого-либо определенного порядка. В результате образуются декстрины, а коли-
чество нередуцирующих концов – мест атаки
β
-амилазы, существенно
возрастает.
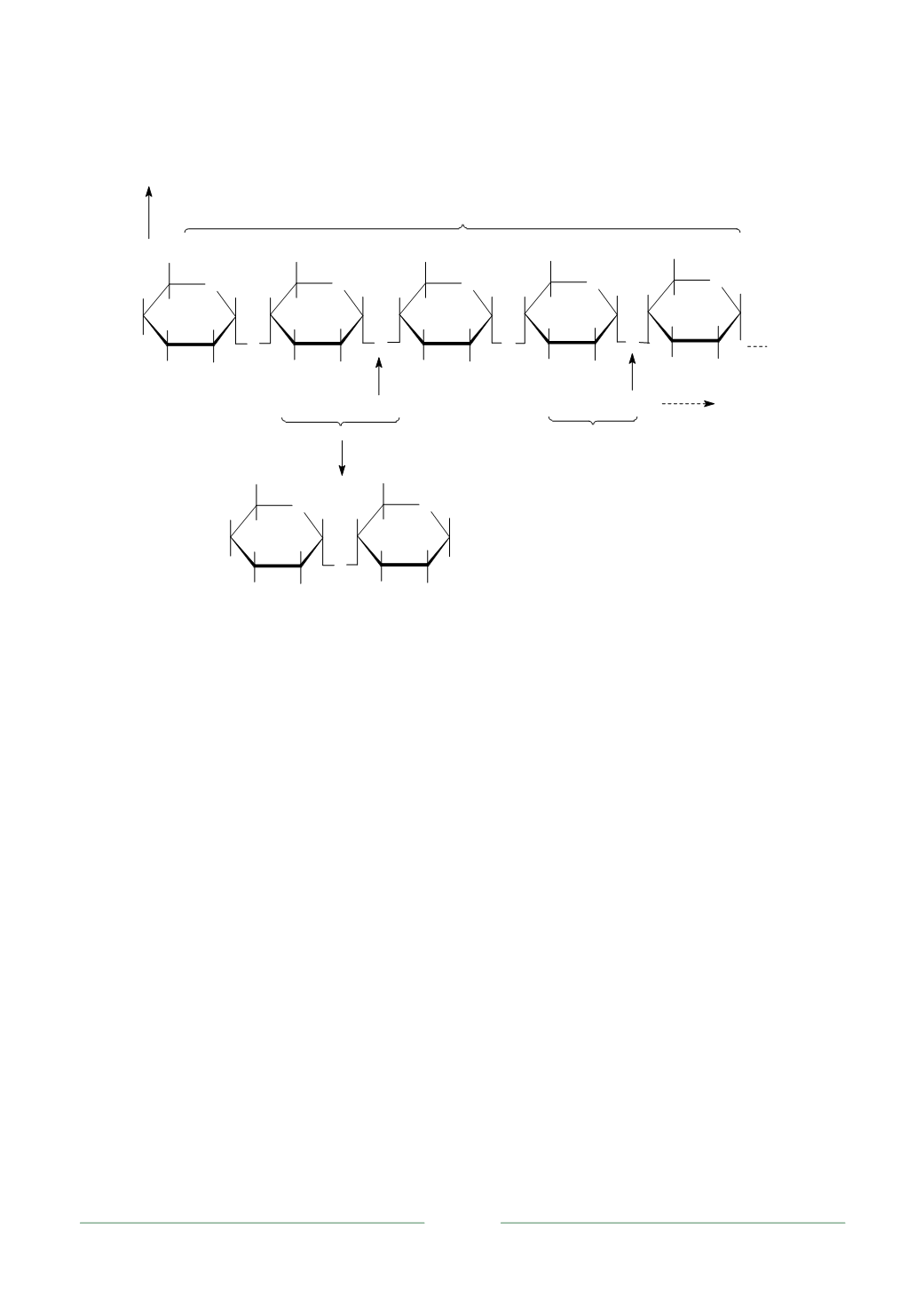
Каталитический центр амилаз образован остатками гистидина, аспараги-
новой или глутаминовой кислоты. Предполагается, что субстратный центр не
перекрывается с каталитическим и образован несколькими фрагментами тиро-
зина (рис. 3.11), который за счет водородных связей с пиранозным кислородом
полисахарида фиксирует субстрат таким образом, что в каталитическом центре
оказывается внутренняя О-гликозидная связь (рис. 3.12,
а
).
H
CH
2
OH
H
H
OH H
OH H
O
H OH
H OH
H
H
CH
2
OH
H
O
O
OH
O
OH
и так далее
+ H
2
O
H
2
O
невосстанавливающий
конец молекулы
(спиртовой гидроксил)
OH
H
CH
2
OH
H
H
OH H
OH H
O
O
O
H
CH
2
OH
H
H
OH H
OH H
H OH
H OH
H
H
CH
2
OH
H
O
O
O
O
O
H
CH
2
OH
H
H
OH H
OH H
O
H OH
H OH
H
H
CH
2
OH
H
+
биозный фрагмент крахмала


