22
H
O
H
H
O
H
H
H
H
H
H
H
O
H
O
H
H
O
H
O
O
O
HO
H
H
H
OH
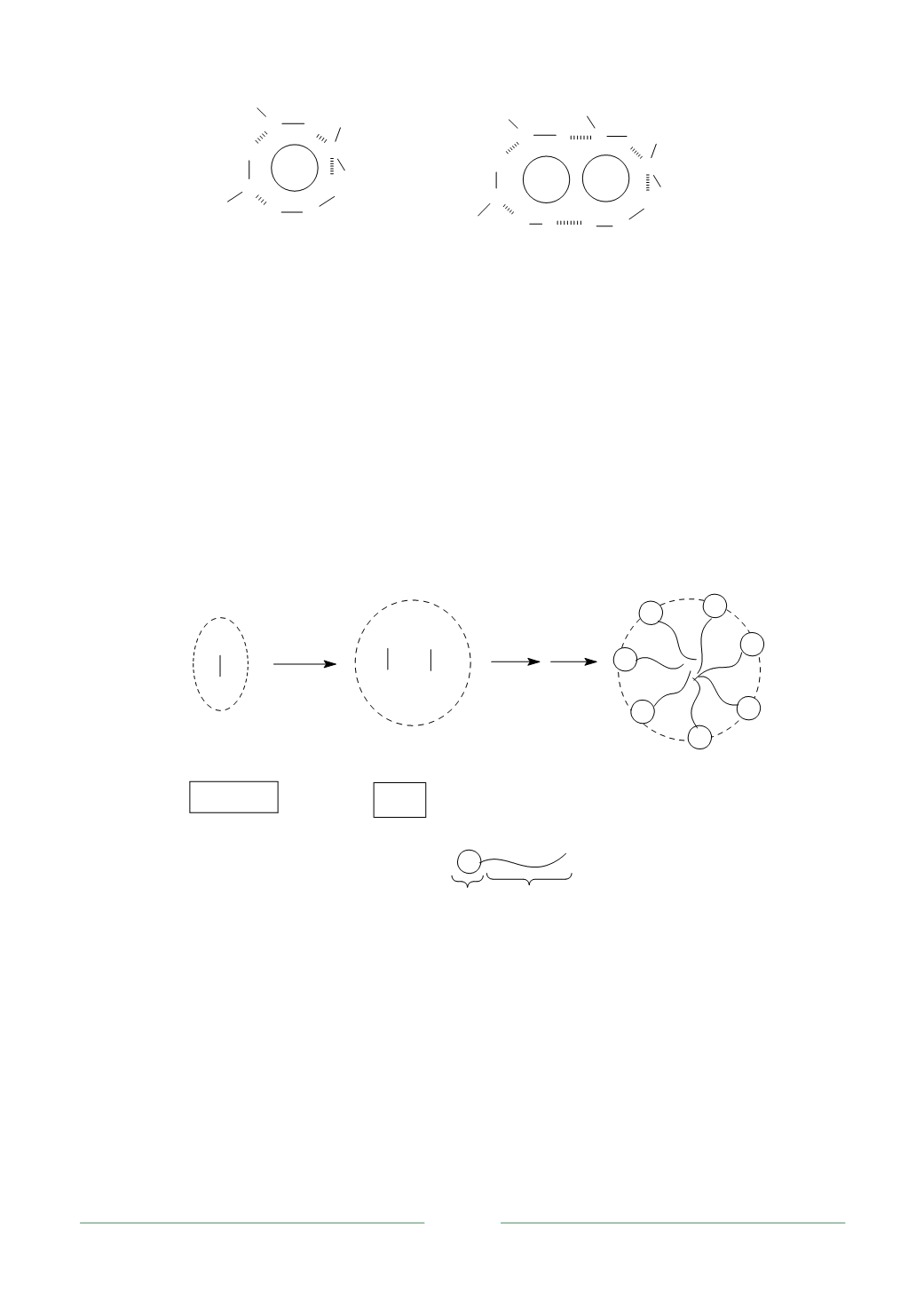
а б
Рис. 1.2. Схема ориентации связанных водородными связями молекул воды
вокруг одной молекулы неполярного углеводорода (
а
) и двух молекул (
б
)
(гидрофобный углеводород схематично представлен сферическим)
Энтропийный фактор
Т
Δ
S
вносит свой вклад в дестабилизирующий эф-
фект воды, выраженный через изменение
Δ
G
:
STH G
Δ−Δ=Δ
.
При положительном энтальпийном и отрицательном энтропийном факторе зна-
чение
Δ
G
, отражающее с термодинамической позиции, насколько дестабилизи-
рована вода, является положительным:
Δ
G
=
G
(вода с полостями)
–
G
(чистая вода)
> 0.
Уменьшение дестабилизации растворителя происходит в результате са-
мопроизвольного процесса кооперативного объединения молекул растворенно-
го вещества в одной полости (рис. 1.2,
б
и рис. 1.3):
R
X
2
x
полость
R
X
R
X
2 x
G
>
G
полость
X R
I
II
III
Рис. 1.3. Схема объединения молекул растворенного дифильного вещества
в полости растворителя:
Х – полярный фрагмент дифильной молекулы;
R – гидрофобный (неполярный) фрагмент дифильной молекулы
В полости II (рис. 1.3) неизбежно сближение молекул дифильного веще-
ства, и оно происходит таким образом, чтобы было как можно больше контак-
тов между гидрофобными фрагментами, усиливающих дисперсионное взаимо-
действие между ними. Энергия дисперсионного взаимодействия определяется
выражением


