20
чие от энтальпийной характеристики, энтропия растворения отрицательна для
всех типов гидрофобных веществ.
Аналогичные закономерности наблюдаются и для алифатических спир-
тов, обладающих гидрофобными (дифильными) свойствами. Важным представ-
ляется и тот факт, что парциальные мольные объемы гидрофобных соединений
меньше, чем мольные объемы чистых веществ. Эта особенность, а также отри-
цательная энтропия растворения свидетельствуют о более упорядоченном со-
стоянии гидрофобного вещества в растворе. Под действием воды плотность
растворенного вещества увеличивается, оно как бы подвергается определенно-
му сжатию со стороны растворителя.
Эти не совсем обычные явления обусловлены особенностями строения
жидкой воды. Элементный состав и биполярное строение молекул воды предо-
пределяет образование между молекулами прежде всего водородных связей.
При этом каждая молекула воды проявляет свойства как донора, так и акцеп-
тора водорода. Поэтому у воды в жидком состоянии молекулы связаны между
собой водородными мостиками с образованием ассоциатов, находящихся в ди-
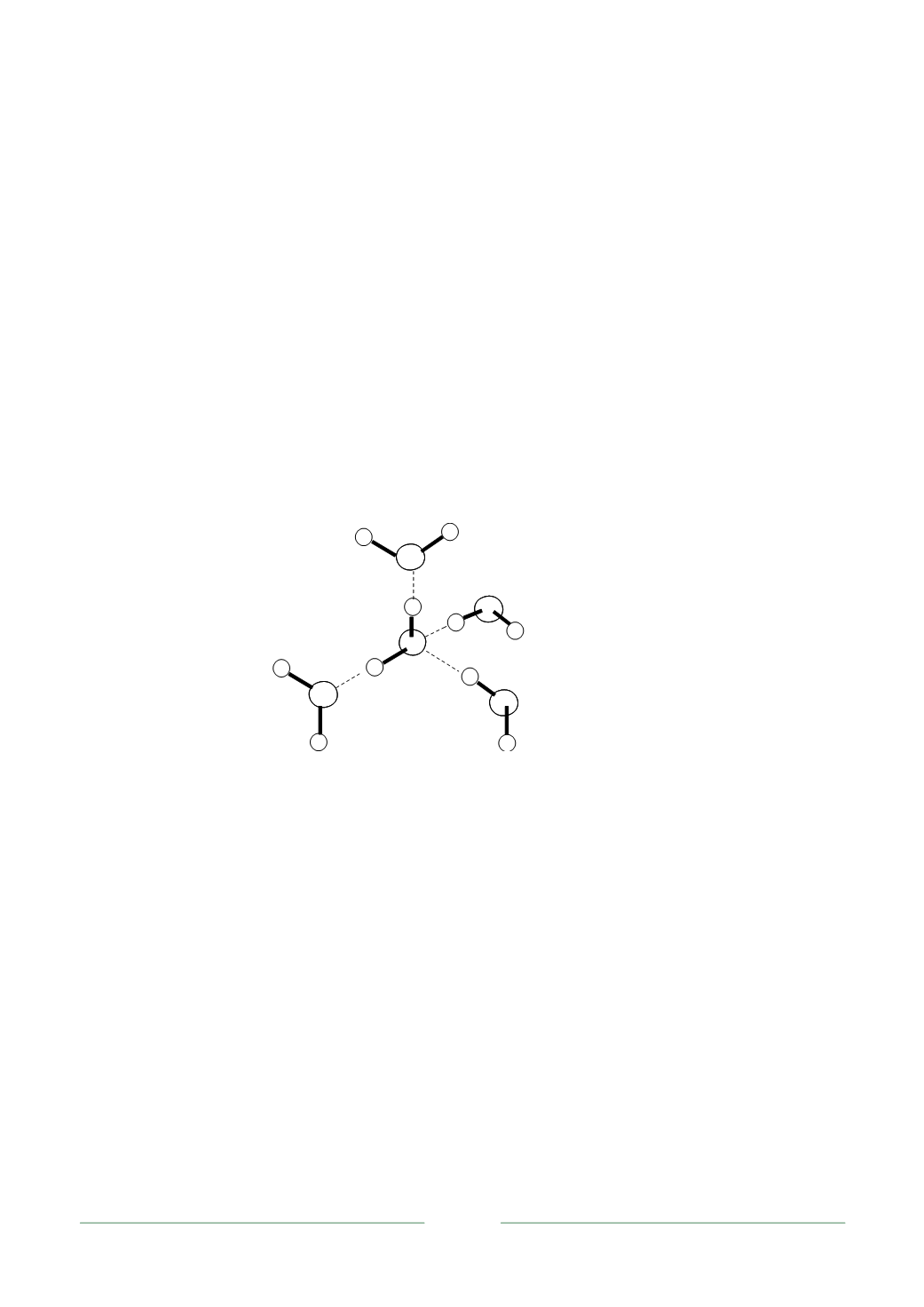
намическом равновесии (рис. 1.1).
Рис. 1.1. Схема тетраэдрического связывания в жидкой воде
Образуются тетраэдрические структуры, так называемые кластеры воды,
в которых молекула воды взаимодействует с четырьмя тетраэдрически ориен-
тированными соседями. Таким образом, молекулы воды образуют подвижную
сетку, причем каждая молекула ориентирована таким образом, чтобы по воз-
можности были реализованы все водородные взаимодействия с соседними мо-
лекулами.
При растворении гидрофобных веществ происходит разрыв водородных
связей в определенном объеме растворителя, и в образовавшейся полости раз-
мещаются молекулы растворенного вещества. Полости вызывают энергетиче-
скую дестабилизацию воды, поскольку в результате их образования мольная
энтальпия растворения увеличивается. Уменьшение дестабилизирующего эф-
фекта происходит за счет самопроизвольной реорганизации воды, непосредст-
венно примыкающей к полости. Молекулы воды стремятся расположиться та-
ким образом, чтобы восстановить максимальное число водородных связей: три


