258
Δ
G
некат
=
/
Δ
G
0
G
координата реакции
Δ
G
1
=
/
Δ
G
0
G
координата реакции
[Ce
4+
.... Mn
2+
]
[Ce
4+
.... Mn
3+
]
[Tl
+
.... Mn
4+
] =
=
/
/
=
/
Δ
G
2
/
=
Δ
G
3
/
=
а б
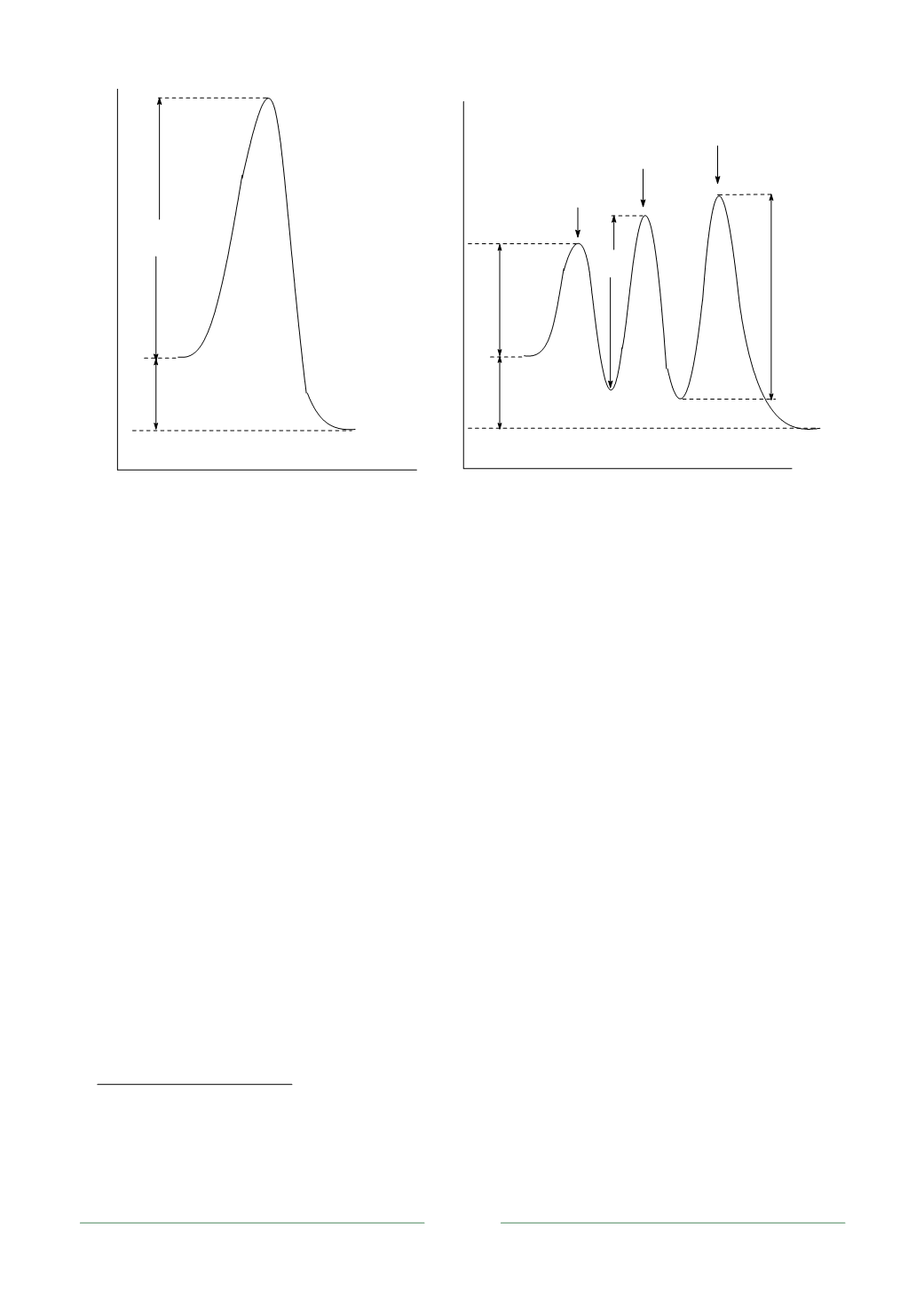
Рис. 4.2. Изменение энергии Гиббса в некаталитической (
а
)
и каталитической (
б
) реакции
Экспериментальные данные по изучению механизма гетерогенного ката-
лиза показывают, что основой каталитической активации реагентов является
адсорбция, по крайней мере, одного из них, на поверхности твердого катализа-
тора. Роль адсорбции в гетерогенном катализе можно выразить таким положе-
нием: твердое вещество может проявить каталитическое действие, если на нем
возможна адсорбция реагентов. Адсорбция – самопроизвольный процесс, и ее
движущей силой является снижение (в результате адсорбции) поверхностного
натяжения, или, что то же самое, поверхностной энергии Гиббса
G
S
твердого
катализатора.
Твердые вещества имеют очень большие значения поверхностного натя-
жения даже при высоких температурах
*
. В табл. 4.7 в качестве примера приве-
дены поверхностные натяжения наиболее распространенных металлических ка-
тализаторов, а также Al
2
O
3
. Из-за высоких поверхностных натяжений на по-
верхности твердых веществ мгновенно адсорбируются газообразные вещества
из окружающей атмосферы, которые десорбируются в достаточно жестких ус-
ловиях. Поэтому получение чистых поверхностей твердых веществ, в том числе
и катализаторов, представляет собой сложную экспериментальную задачу.
*
Методы определения поверхностного натяжения твердых веществ имеют относи-
тельно невысокую точность, которая возрастает при увеличении температуры.


