119
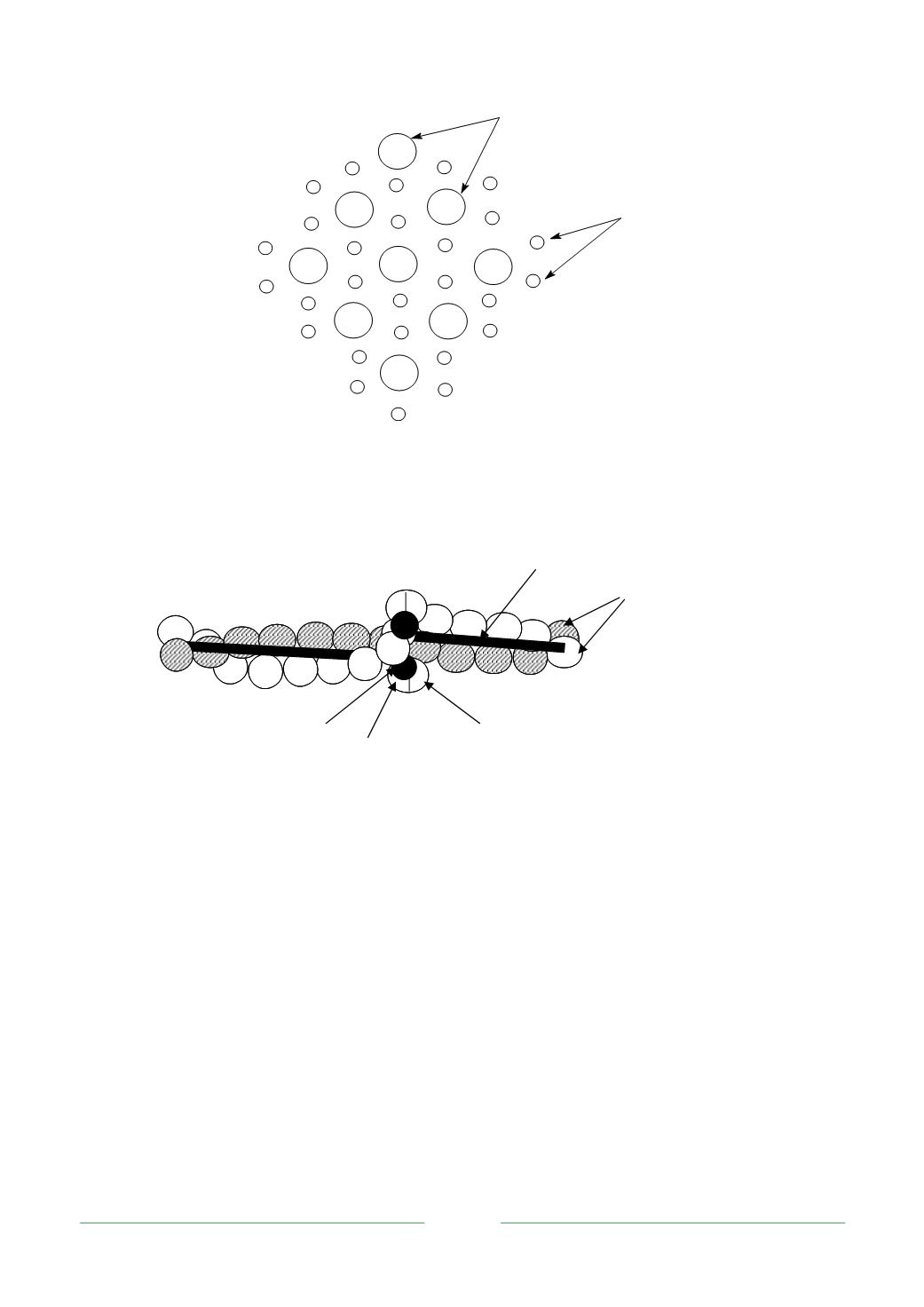
Рис. 2.11. Схема расположения относительно друг друга толстых
и тонких филаментов
2.12. Строение тонкого филамента, в составе которого актин, тропомиозин
и тропонин (Т- тропонинсвязывающая субъединица тропонина,
С- кальцийсвязывающая, I- ингибирующая)
Тропомиозин составляет около 10-12 % белков миофибрилл. Он состоит
из двух субъединиц, переплетающихся между собой в
α
-спиралевидные фиб-
риллярные структуры. Тропомиозин связывается в единый белковый комплекс
с одной из цепей F-актина, охватывая примерно семь актиновых мономеров. В
чистом виде тропомиозин легко растворяется в воде, но из мышечной ткани во-
дой не извлекается, что свидетельствует о достаточно прочном взаимодействии
с актином. В функционирующих миофибриллах тропомиозин регулирует мы-
шечное сокращение.
Тропонин состоит из трех разных по структуре и функциям субъединиц:
тропонинсвязывающей (Т), кальцийсвязывающей (С) и ингибирующей (I). В
тонком филаменте он находится на конце каждой молекулы тропомиозина.
Функциональное назначение каждой из субъединиц будет рассмотрено далее.
толстые филаменты
тонкие филаменты
G-актин
тропомиозин
Т
С
I


