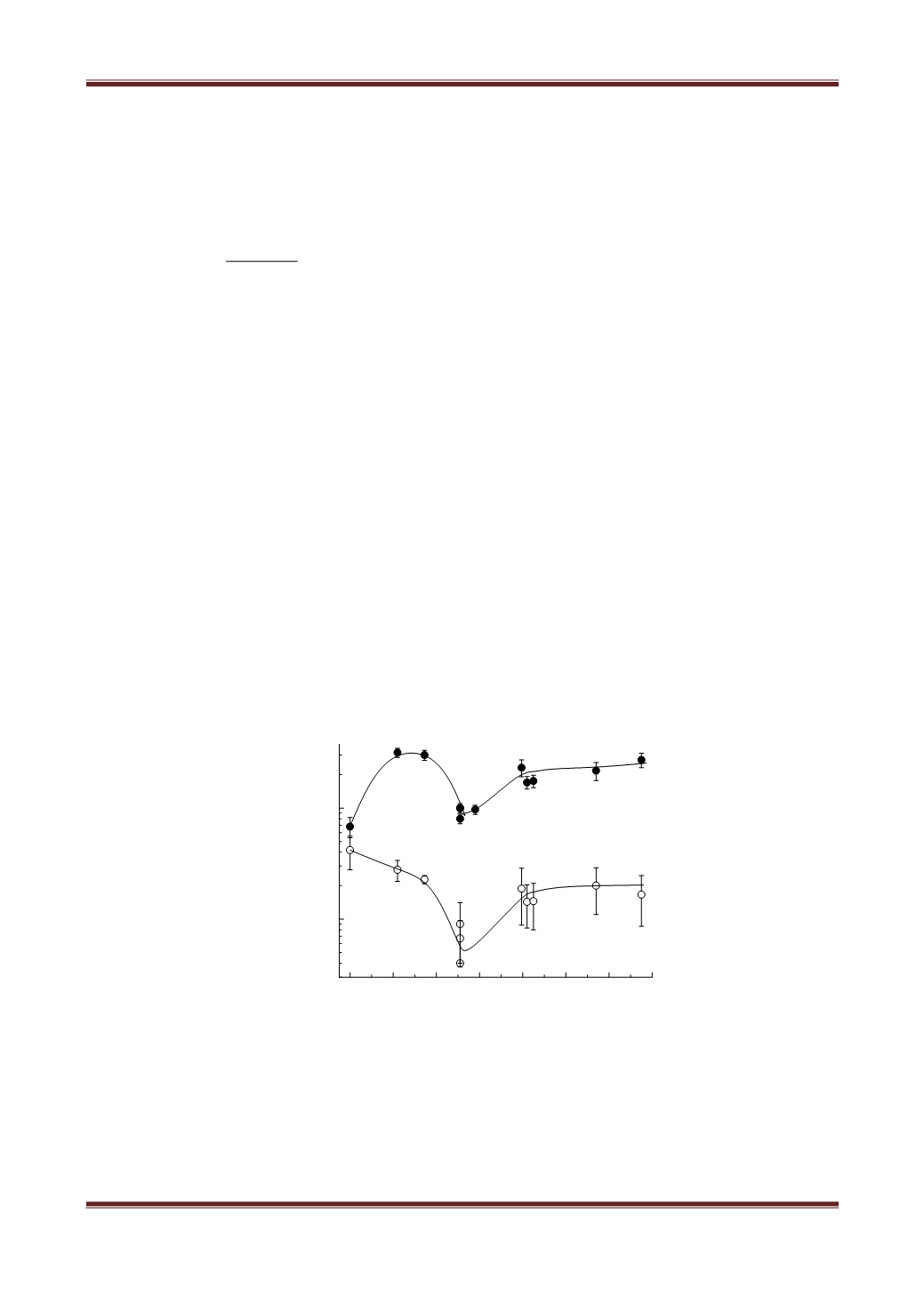
" Н а у к а м о л о д ы х " , 3 0 - 3 1 м а р т а 2 0 1 7 г . , А р з а м а с
П о с в я щ а е т с я 1 0 0 - л е т и ю Р о с т и с л а в а Е в г е н ь е в и ч а А л е к с е е в а
76
Действие разряда действительно приводило к восстановлению бихромат-
ионов и деградации Ph. При этом полная концентрация ионов хрома в растворе
не менялась. Кинетические кривые обрабатывались по соотношению,
полученному в [14]:
{
}
2
2 1
1
2 1
0
] )
(
exp[
] [
)] ( [
K t
K K
K
K K
M tM
+× + − × ×
+
=
, (1)
где
[М]
0
-начальная концентрация компонента,
t
- время,
К
1
- константна
скорости прямой реакции,
К
2
– константа скорости обратной реакции.
При выводе (1) предполагалось, что вещество расходуется по первому
кинетическому порядку с константой скорости
К
1
, образуется в обратной
реакции из продукта с константой скорости
К
2
, а суммарные текущие
концентрации вещества и продукта сохраняются и равны
[М]
0
. Если вещество
разлагается обратимо, то
К
2
и
К
1
близки, а если необратимо, то
К
1
>> К
2
.
Конечно, указанные константы скорости являются эффективными, и в них
должны входить концентрации частиц, образовавшихся под действием разряда
и которые участвуют в окислительно-восстановительных процессах и
процессах деструкции. Оказалось, что (1) хорошо описывает кинетические
кривые как восстановления Сr
6+
, так и расходования Ph (R
2
>0.98). Это значит,
что концентрации активных частиц за времена опытов успевают установиться,
а их гибель в исследуемых процессах слабо влияет на концентрацию.
На Рис. 2 приведены константы
К
1
и
К
2
в зависимости от начальной
концентрации фенола для максимальной и минимальной исследованных
концентраций Сr
6+
и токе 40 мА.
0.00 0.02 0.04 0.06 0.08 0.10 0.12 0.14
10
-3
10
-2
2
1
К, с
-1
С
Ph
, ммоль/л
Рис. 2. Зависимость эффективной константы скорости восстановления Cr
6+
(1) и
окисления Cr
3+
(2) от начальной концентрации фенола. Ток 40 мА. Начальная
концентрация Cr
6+
0.19 ммоль/л