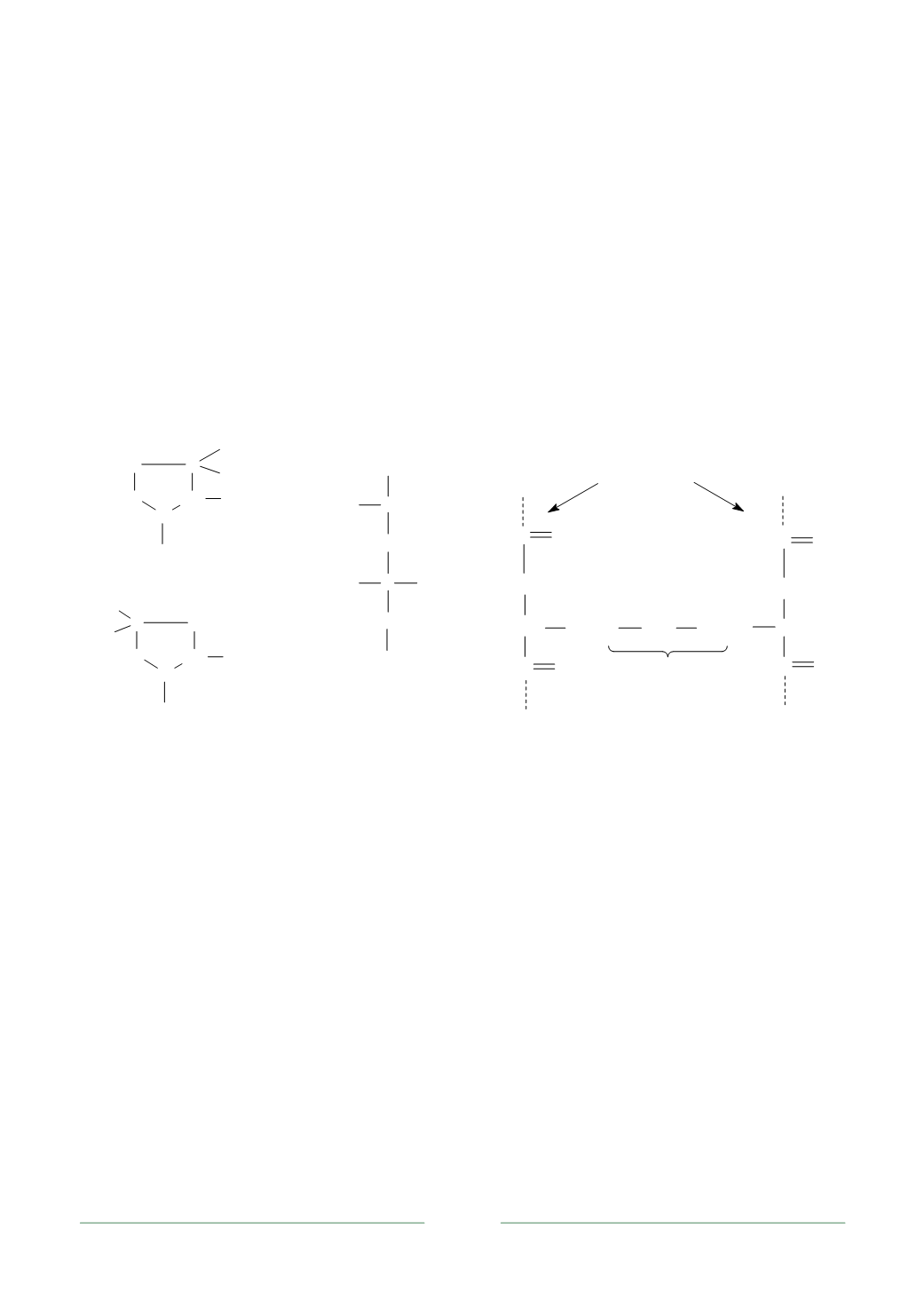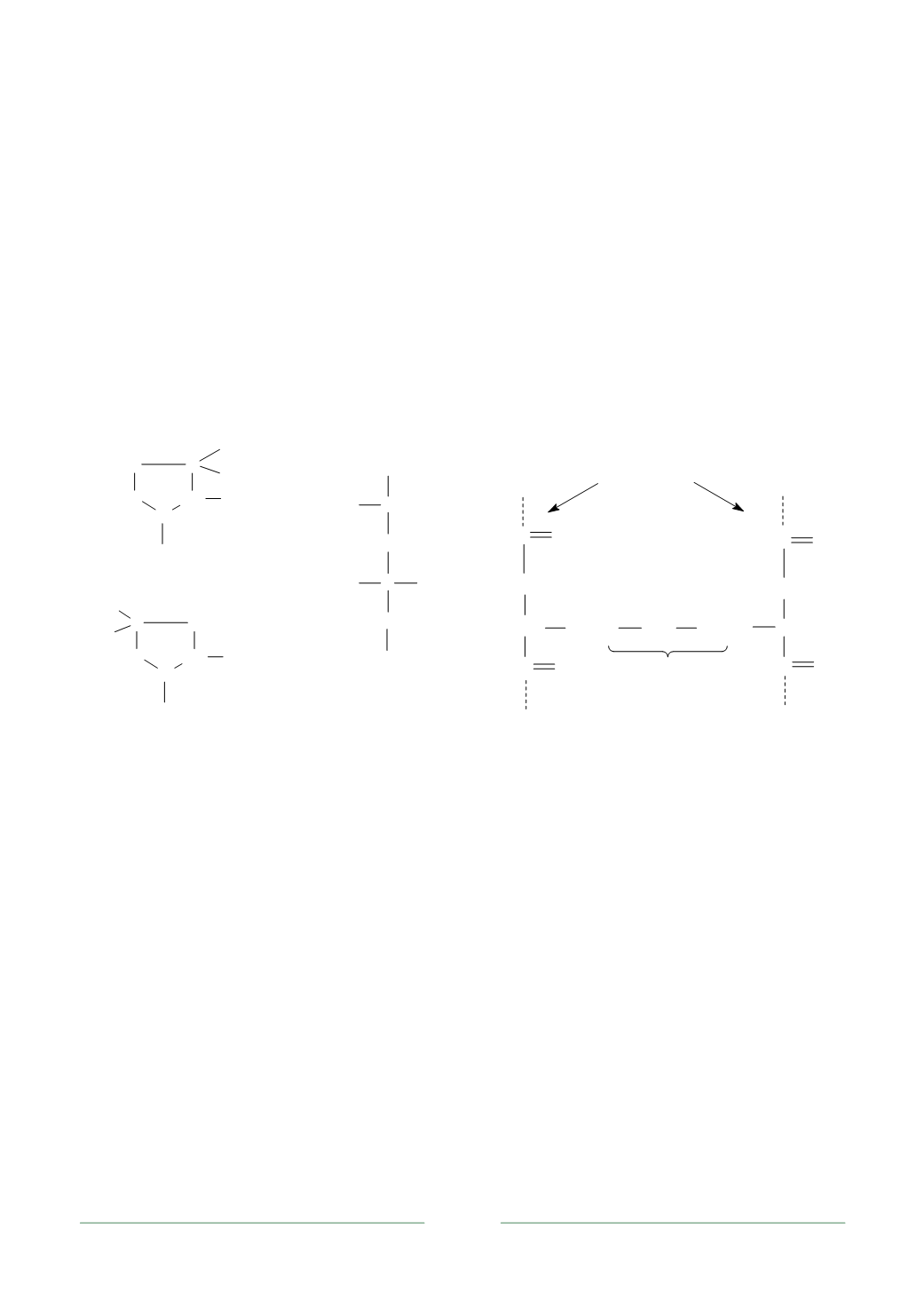
120
2.1.3. Белки стромы
Белки стромы входят в состав сарколеммы и рыхлой соединительной
ткани, объединяющей мышечные волокна в пучки. К ним относятся коллаген,
эластин, ретикулин. В скелетных мышцах содержание коллагена не превышает
1-2 %, хотя в целом, это самый распространенный белок в организме млекопи-
тающих. Его количество в среднем составляет около 25-33 % от белков всех
тканей млекопитающего. Наиболее широко он представлен в плотной соедини-
тельной ткани, хрящевой и костной.
Коллаген имеет необычный аминокислотный состав: около 33 % состав-
ляет глицин, примерно 20 % пролин, гидроксипролин и гидроксилизин, причем
оксиаминокислоты образуются после биосинтеза коллагена путем посттрансля-
ционной модификации. В структуре коллагена постоянно повторяется триплет
Гли-Х-У, причем положение Х часто занимает пролин, а У – 5-гидроксилизин,
4-гидроксипролин, 3-гидроксипролин:
CH
C
H
2
C
H
2
C
N
H
COOH
3
4
COOH
H
CH
CH
2
C
H
2
C
N
H
OH
H
HO
CH
(CH
2
)
2
C H
OH
CH
2
NH
3
+
COO
-
NH
3
+
C O
NH
CH (CH
2
)
4
NH (CH
2
)
4
CH
C O
C O
NH
C O
3-гидроксипролин
4-гидроксипролин
5-гидроксилизин
ковалентная сшивка
между двумя фрагментами
лизина
полипептидные цепи
Типичная молекула коллагена состоит из трех полипептидных цепей раз-
ных видов:
α
-1,
α
-2,
α
-3, скрученных в виде правой тройной спирали. Через
фрагменты лизина образуются внутримолекулярные ковалентные поперечные
связи, стабилизирующие структуру коллагена. Такая ассоциация невозможна в
обычной
α
-спирали, поскольку этому бы препятствовали объемные боковые
заместители. В коллагене спирали более вытянуты – на один виток приходится
три аминокислотных остатка (рис. 2.13,
а
,
б
). Поскольку каждый третий из них
глицин, у которого боковой фрагмент отсутствует, спирали максимально при-
ближены друг к другу в точках образования ковалентной сшивки между цепя-
ми. Дополнительная стабилизация осуществляется за счет водородных связей
между гидроксилированными фрагментами лизина и пролина.
Известно 12 вариантов коллагена, характеризующихся различным соче-
танием полипептидных
α
-цепей. Наиболее общий тип коллагена имеет состав
(
α
-1)
2
α
-2. Большинство коллагенов образуют фибриллы цилиндрической фор-
мы диаметром 20-500 нм.
Нативный коллаген устойчив к химическому воздействию растворов ки-
слот, щелочей, протеолитических ферментов (пепсина, трипсина), он нераство-