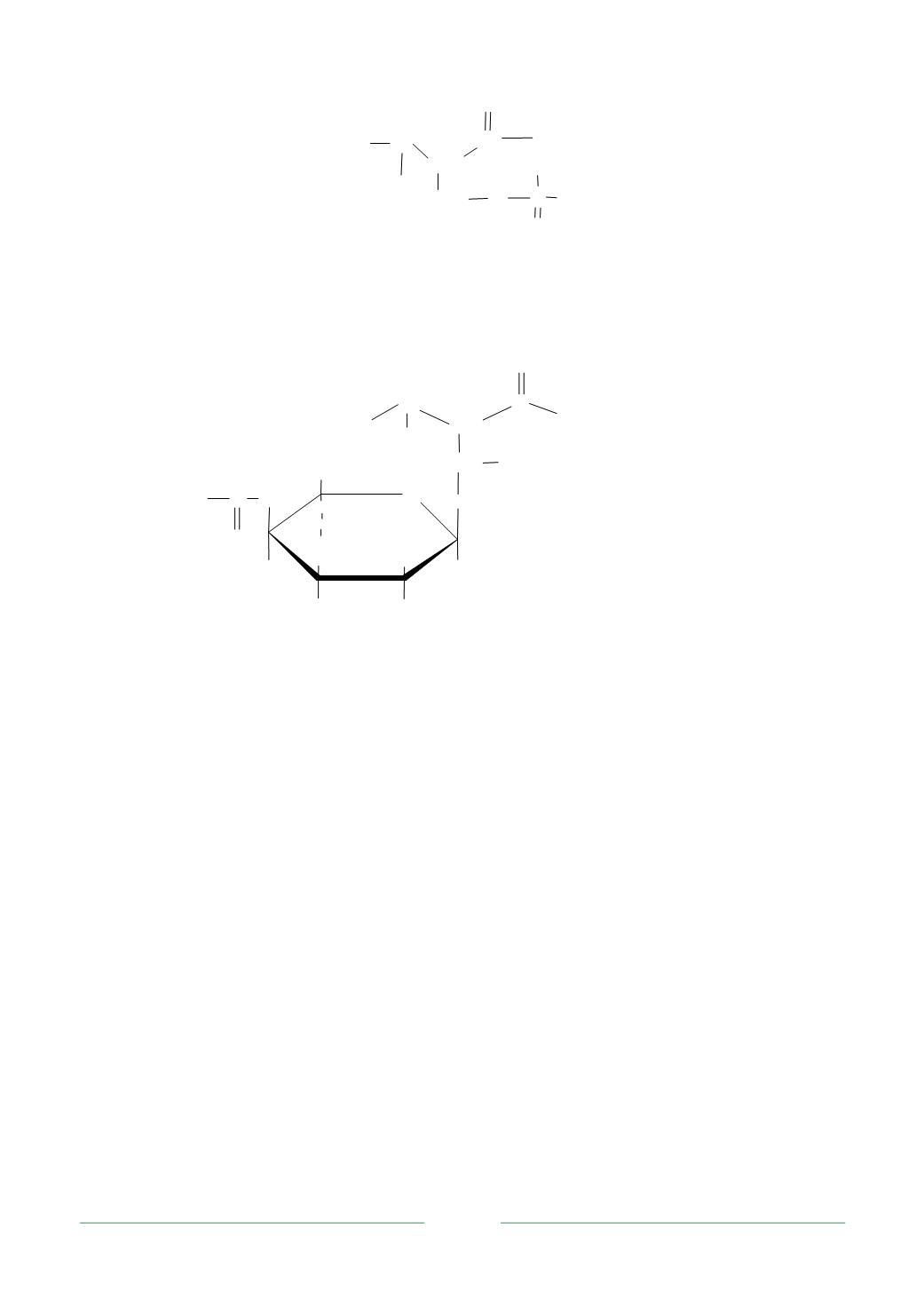
15
N
H
C
CH
O
в полипептидную цепь
P
O
-
O
-
O
O CH
2
в полипептидную цепь
В гликофосфопротеине –
κ
-казеине, содержащем только один фосфо-
сериновый фрагмент, дополнительный отрицательный заряд формируется за
счет карбоксилатных групп сиаловой кислоты, связанной О-гликозидной свя-
зью с фрагментами треонина
κ
-казеина:
O
CH
3
C NH
H
CH
2
OH
H
H
COO
-
OH H
O
CH
3
CH
CH
в полипептидную цепь
в полипептидную цепь
C
H
N
O
H
CHOH
CHOH
O
Как было проиллюстрировано на примере короткого фрагмента
-Кн В -8Р, при снижении рН в соответствии с константами протолитических
равновесий происходит нейтрализация отрицательных зарядов, и при опреде-
ленном значении рН количество положительно заряженных аминокислотных
фрагментов белковой молекулы становится равным количеству отрицательно
заряженных. Это состояние, как известно, называется изоэлектрическим. Для
-Кн изоэлектрическая точка pI находится в интервале 4,44-4,76.
1
α
s
1
α
s
В изоэлектрическом состоянии стабильность казеинов самая низкая и
они коагулируют. В целом суммарный заряд белковой молекулы при рН < pI
положительный, а при рН > pI – отрицательный.
В свежем молоке с рН 6,6-6,8 ионогенные аминокислотные фрагменты
несут как отрицательные (Глу, Асп, серинфосфат, сиаловая кислота), так и по-
ложительные заряды (лизин, аргинин, гистидин), причем отрицательный заряд
вследствие наличия остатков серинфосфата и сиаловой кислоты преобладает.
Белки молока характеризуются очень высокой степенью гидратации, не-
смотря на значительное содержание в их составе аминокислот с гидрофобными
свойствами (табл. 1.1). Это обусловлено тем, что белки в водной среде облада-
ют почти универсальной структурной особенностью: ионные и полярные фраг-
менты расположены на поверхности белковых молекул, тогда как неполярные
аминокислотные остатки спрятаны внутри белковой цепи (гидрофобный эф-
фект). В настоящее время определены количественные характеристики, так на-


